布拉德福特实验室

传染病/病原体是指在人群中新出现或已经存在但发病率或地理范围迅速增加的疾病/病原体

鹿鼠 Peromyscus maniculatus 携带 Sin Nombre 汉坦病毒,它是美国大部分汉坦病毒心肺综合征病例的罪魁祸首。
照片来源:山姆·古德费罗

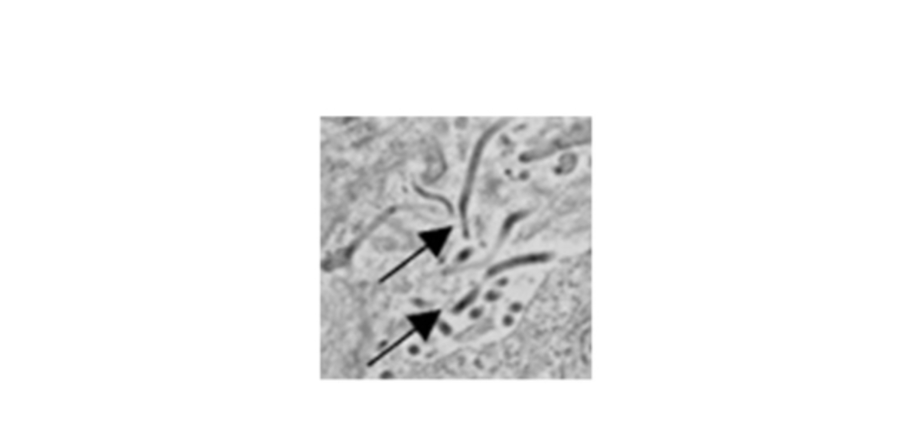
感染的脾脏中的埃博拉病毒。 箭头指向单个病毒粒子。 使用透射电子显微镜进行成像。
图片来源:Steven Bradfute 博士

寨卡病毒斑块测定以鉴定中和抗体
图片来源:Steven Bradfute 博士
埃博拉病毒感染导致免疫细胞死亡。 荧光显微镜显示来自受感染动物的脾细胞。 红色标记死亡细胞并显示所有细胞。
图片来源:Steven Bradfute 博士
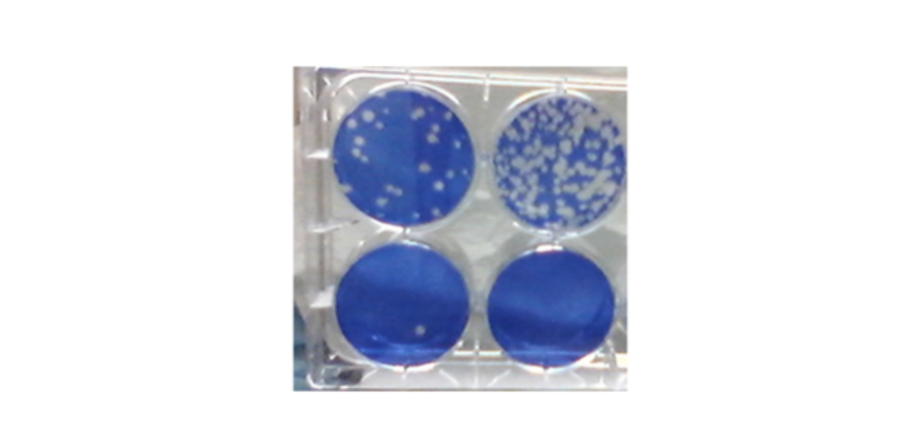
用于测量冠状病毒复制抑制的 SARS-CoV-2 斑块测定。 蓝色是活细胞; 洞是“斑块显示SARS-CoV-2感染和杀死细胞的地方。
图片来源:Steven Bradfute 博士
汉坦病毒是导致人类严重疾病的危险病原体。 病毒在啮齿动物中无害地复制,并通过吸入雾化啮齿动物排泄物中的病毒传播给人类。 美国第一种致病性汉坦病毒,Sin Nombre 汉坦病毒,于 1993 年在新墨西哥州被发现。新墨西哥州的 Sin Nombre 汉坦病毒病例比其他任何州都多,使其成为我们地区的重要病毒,特别是考虑到其高致死率率(~35%)。 我们的研究涵盖汉坦病毒生物学和治疗学的多个领域。
-用于治疗的中和抗体。
作为基于阿尔伯特爱因斯坦医学院的 NIH U19 赠款的一部分,我们进行了合作,以识别和分析针对多种汉坦病毒的单克隆抗体。 联盟使用这些数据来选择抗体,以测试它们从感染中拯救小动物模型的能力。 这项合作研究在“本周病毒学”播客中得到了强调:https://www.microbe.tv/twiv/twiv-578/
-- Sin Nombre 汉坦病毒幸存者的长期记忆免疫反应。
我们正在追踪 Sin Nombre 汉坦病毒幸存者的长期免疫反应。 迄今为止,我们已经在幸存者中发现了非常强烈的抗体反应,感染后 23 岁的患者仍然表现出可检测到的中和抗体反应。 这些数据表明,汉坦病毒幸存者对再次感染产生了强大、持久的免疫力。 我们还建立了一种 13 色流式细胞术检测,以测试多个记忆 CD8+ 和 CD4+ T 细胞隔室中的特定汉坦病毒回忆反应。
--新墨西哥州野生啮齿类动物Sin Nombre Virus的遗传分析。
Sin Nombre 汉坦病毒的宿主啮齿动物是鹿鼠 Peromyscus maniculatus。 鹿鼠的自然分布范围非常广泛,因为它们几乎在美国所有地区(不包括东南部地区)都有发现。 然而,人类中的 Sin Nombre 病毒感染主要集中在美国西部和西南部。 我们问的问题是“为什么到处都是鹿鼠,而被感染的人却没有?” 我们通过在新墨西哥州的人类感染流行区和非流行区捕获野生鹿鼠来回答这个问题,以确定 a) Sin Nombre 病毒是否仅在人类患者流行区发现,或 b) 病毒基因组序列不同地区有显着差异。

Bradfute 实验室利用我们在新兴病毒病原体方面的专业知识来研究 2013-2016 年爆发期间的寨卡病毒。 我们与洛斯阿拉莫斯国家实验室合作,测试新型 DNA/纳米颗粒递送系统在保护小鼠免受寨卡病毒感染方面的功效。 我们发现,在新型递送系统中配制的质粒 DNA 疫苗以剂量依赖性方式诱导小鼠对抗寨卡病毒感染的保护性免疫。
Hraber P、Bradfute SB、Clarke E、Ye C 和 Pitard B。针对寨卡病毒的 DNA 疫苗的两亲性嵌段共聚物递送。 疫苗 36:6911 (2018)

Bradfute 实验室参与测试新型疫苗,以诱导针对多种脑炎病毒的交叉反应性免疫反应,这些病毒由蚊子传播并在马和人类中引起严重疾病。
-- 用于广泛保护性单剂量甲病毒疫苗的纳米载体抗原递送。
我们正在与洛斯阿拉莫斯国家实验室 (LANL) 合作测试一种新型基于 DNA 的疫苗,以提供针对多种甲病毒的单次注射、持久免疫力。 我们在这次合作中的作用是测试 DNA 疫苗在小鼠体内诱导抗体和 T 细胞反应的能力,使用 BSL-3 甲病毒作为靶标。
——委内瑞拉马脑炎病毒感染中的长链非编码RNA。
我们最近刚刚获得了一项大型项目的资助,该项目研究长链非编码 RNA 在委内瑞拉马脑炎病毒感染的细胞反应中的作用。 该项目将利用我们在 UNM HSC 的精选代理 BSL-3 设施来测试与相同病毒的非致病版本相比,在体外和体内感染致病性委内瑞拉马脑炎病毒后表达哪些长非编码 RNA。 通过这种方式,我们将能够直接比较在成功的细胞反应和不成功的反应中诱导或抑制了哪些长非编码 RNA。
埃博拉病毒是一种致命的病原体,死亡率超过 40%。 尽管传统上仅限于孤立村庄的小规模爆发,但该病毒首次开始传播到大城市,并在 2013 年至 2016 年间引发了全球爆发。 我们参与了针对这种病毒的疫苗和疗法开发工作。
-埃博拉病毒疫苗和疗法开发。
我们发现病毒糖蛋白中的糖基化(糖模式)变化极大地影响了这些蛋白质在用作疫苗时如何诱导免疫反应。 当疫苗在不同的细胞类型中制造时,糖基化会发生这些变化。 我们的发现是相关的,因为不同的细胞类型用于不同的疫苗。
- 埃博拉病毒治疗和疫苗联合给药。
我们的埃博拉病毒研究在最近获得第二笔赠款的资助下继续进行,其中我们正在研究将短期疗法与长期疫苗一起使用如何影响这些疗法的功效。 目标是确定给予两种治疗药物的最佳时机,以便在不取消联合接种疫苗的长期保护的情况下立即针对病毒提供保护

鉴于当前冠状病毒大流行的紧迫性,布拉德富特实验室率先在 UNM HSC 开展了 BSL-3 SARS-CoV-2 病毒工作。 我们与超过 25 个不同的学术和商业团体合作,利用我们独特的专长来研究 SARS-CoV-2 的疗法、疫苗、灭活、基础生物学和患者样本分析。
-- 评估恢复期和急性 COVID-19 患者的中和抗体。
Bradfute 实验室在 UNMH 测试了恢复期个体血浆和急性 COVID-19 患者血浆中的中和抗体滴度,这些患者在 UNMH 注射了恢复期血浆作为实验性疗法。 我们发现,虽然通过酶联免疫吸附试验 (ELISA) 测量时,所有接受测试的恢复期患者针对 Spike 表面蛋白的抗体滴度均为阳性,但恢复期个体中抗活 SARS-CoV-2 的中和抗体水平非常低,因此不会提高受体的抗体水平或改善疾病的进展。 这项研究强调了预先筛选恢复期血浆的重要性,不仅是通过 ELISA 检测总抗体,还包括在患者输注前中和抗体滴度。 我们还与 TriCore 参考实验室合作,证明中和抗体滴度与商业上使用的简单快速抗体检测分析相关,不需要使用活病毒。
-- 在表面灭活 SARS-CoV-2 的方法。
我们已经测试了几种化学、热、光和其他方法来灭活活的 SARS-CoV-2。 我们还证明,通常建议的用干热消毒 N95 口罩的方法不能有效消除活的 SARS-CoV-2。
-- 康复期 COVID-19 个体的纵向抗体和 T 细胞反应分析。 我们最近得到了 UNM HSC CTSC 的资助,用于跟踪患者从 SARS-CoV-2 感染中康复后的免疫反应。 我们有一个 IRB 批准用于这项工作,目前正在招募 50 名患者来分析他们长达 10 年的抗体和 T 细胞反应。 这项工作将回答有关 COVID-19 幸存者对病毒的免疫反应多长时间的重要问题。
-- 针对 SARS-CoV-2 的小分子体外筛选。
我的 SARS-CoV-2 工作的主要方面之一是在 BSL-3 实验室中测试小分子对活病毒的体外功效。 我们与 UNM HSC、UNM 主校区和非 UNM 机构合作,测试他们的药物的抗病毒活性。 我的实验室已经筛选了许多小分子,并发现了少数能有效抑制复制的分子。 这项工作导致了许多赠款提交以及准备或提交的手稿,下面列出了其中的样本。