研究
NMARC 研讨会 –秋天2023
“胎儿酒精谱系障碍的治疗”
Jennifer Thomas,博士,圣地亚哥州立大学心理学系
26年2023月XNUMX日,星期四
“行为干预措施可减轻发育期酒精暴露对大脑灰质和白质的影响”
Anna Klintsova,博士,特拉华大学心理学系
16 年 2023 月 XNUMX 日星期四
新墨西哥酒精研究中心
1 新墨西哥大学
阿尔伯克基,新墨西哥州 87131
1 新墨西哥大学
阿尔伯克基, NM 87131
“胎儿酒精谱系障碍的治疗”
Jennifer Thomas,博士,圣地亚哥州立大学心理学系
26年2023月XNUMX日,星期四
“行为干预措施可减轻发育期酒精暴露对大脑灰质和白质的影响”
Anna Klintsova,博士,特拉华大学心理学系
16 年 2023 月 XNUMX 日星期四
新墨西哥酒精研究中心
1 新墨西哥大学
阿尔伯克基,新墨西哥州 87131
1 新墨西哥大学
阿尔伯克基, NM 87131
NMARC P50 结合了交互式临床前和临床研究组件以及检查与 FASD 相关的行为缺陷背后的皮层机制的试点项目。 单击下面的栏可以找到有关每个研究组成部分和试点项目的更多信息:
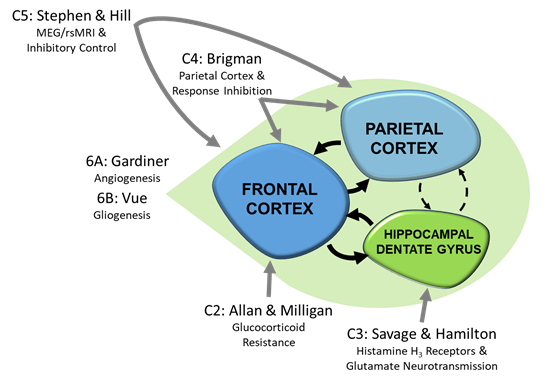
首席研究员: Erin Milligan 博士
联合调查员: 安德里亚艾伦博士, 凯文考德威尔博士 & Nikolaos Mellios,医学博士,博士
许多受 PAE 影响的生理过程受糖皮质激素 (GC) 的调节。 GC 抗性(即对 GC 作用的敏感性降低)与多种慢性疾病有关,其中一些也与 PAE 相关(例如,免疫和炎症疾病、胰岛素抵抗)。 建立终身 GC 响应能力 在子宫内 作为异常糖皮质激素编程的结果。 我们假设 PAE 通过增加胎儿脑生长停滞特异性 5 (Gas5) 来影响 GR 编程,这是一种大量表达的长非编码 RNA,与糖皮质激素受体 (GR) DNA 结合域结合,从而抑制依赖于 GR 的转录调控。 由于 Gas5 水平在出生后大大降低,我们建议 FK506 结合蛋白 51 (Fkbp51) 取代 Gas5 作为成人 GR 依赖性信号传导的主要调节剂,并负责持续的 GC 抗性。 我们将使用我们建立的 PAE 小鼠模型测试假设。 在目标 1 中,我们将评估 PAE 对多种糖皮质激素抵抗的影响,包括对地塞米松抑制皮质酮反应的影响、促炎和抗炎细胞因子水平、Fkbp5 和 Gas5 启动子甲基化水平以及各种特定 GR-调控基因转录。 在目标 2 中,我们将确定 PAE 对小鼠断奶前应激和免疫低反应期响应期间 GC 发育程序的影响。 在目标 3 中,我们将使用有针对性的 在子宫内 干预以测试抑制或减少产前 Gas-5 将恢复 PAE 小鼠正常 GC 敏感性的假设。
联合首席研究员: 丹尼尔萨维奇博士 & 德里克·汉密尔顿
联合调查员: Fernando Valenzuela,博士
我们观察到组胺 H3 受体反向激动剂 ABT-239 可改善 PAE 诱导的齿状回 (DG) 长时程增强 (LTP) 缺陷和大鼠记忆力保留。 此外,PAE 还增加了 H3 受体-效应器偶联并提高 H3 受体介导的 DG 谷氨酸释放抑制 (Varaschin et al., 2018)。 我们假设 PAE 诱导的 H 差异表达3 受体亚型是升高 H 的基础3 受体-效应子偶联和用 H3 受体反向激动剂 SAR152954 将减弱这些 PAE 诱导的增强抑制反应并改善 PAE 诱导的谷氨酸释放和 LTP 缺陷。 在目标 1 中,我们将检查 PAE 对 H 的 rH3A 和 rH3C 亚型的 mRNA 和蛋白质表达的影响。3 受体并检查 PAE 如何改变对 H3 激动剂methimepip和SAR152954。 在目标 2A 中,我们将研究 PAE 如何在体外改变齿状颗粒细胞对甲巯咪咪和 SAR152954 的反应。 在目标 2B 中,我们将这些研究扩展到生理反应记录以及清醒自由移动大鼠齿状回谷氨酸水平变化的记录。
首席研究员: 乔纳森·布里格曼博士
联合调查员: 费尔南多·巴伦苏埃拉,博士
由于对生活质量措施的强烈负面影响,FASD 中执行控制的损害越来越受到关注。 密切合作 朱莉娅斯蒂芬博士 (组件 5),我们越来越关注注意力和认知控制的执行控制领域。 临床上,认知控制是通过持续表现任务 (CPT) 来衡量的,该任务呈现多种刺激类型并要求受试者对目标做出反应,但抑制对非目标刺激的反应。 我们最近验证了一种啮齿动物触摸屏五选择 CPT (5C-CPT),并且有证据表明,在健康人类受试者的脑电图 (EEG) 和小鼠的脑电图样硬脑膜记录期间,顶叶 β 振荡信号具有很强的同源性。 虽然来自 Stephen 博士的新临床数据表明 PAE 削弱了抑制 CPT 反应的能力,但这些缺陷背后的机制尚不清楚。 因此,组件 4 将测试使用触摸屏 5C-CPT 的注意力和反应抑制是否在 PAE 鼠标模型中受损。 鉴于 PAE 确实会损害这些行为的强有力的初步证据,我们建议在硬脑膜和皮层内进行类似 EEG 的记录,以检查 PAE 是否显着改变了 β 振荡信号,以及这些改变是否与对神经元放电模式或时间的影响有关。 有强有力的证据表明,高频振荡是由特定的皮质中间神经元群体控制的,许多研究表明这些群体被 PAE 改变。 因此,我们将通过检查这些神经元细胞类型的数量和功能的改变来检查中间神经元的改变作为 CPT 任务缺陷的假定机制。
我们将利用更广泛的 P50 团队的优势来研究导致 FASD 儿童认知和行为缺陷的潜在机制,重点是抑制功能。 我们之前使用 SART 来区分 ADHD 儿童和 FASD 儿童,从而根据两个人群中揭示的注意力缺陷检查大脑功能的差异。 有趣的是,此任务还可用于检查抑制功能作为 Go/No-Go 任务。 我们在组件 5 项目中的目标是检查 FASD 幼儿相对于健康对照的抑制功能,以了解神经振荡的作用,目的是确定 FASD 儿童的治疗目标。 结合检查任务诱发的神经振荡和任务诱发的连通性测量,我们还将使用 fMRI 和 MEG 检查静息状态连通性。 我们的前提是,神经振荡在调节一个人在静息状态条件下对刺激做出适当反应的能力方面起着主要作用。 结合三个临床前项目中的两个,我们将研究神经振荡在 PAE 中的作用。 与我们之前的研究相比,我们现在将检查 6-8 岁年龄段的儿童。 我们特别有动力根据儿童抑制功能的发展轨迹来研究这个年龄段的儿童。 根据任务指示抑制反应的能力在四岁时发展,成功抑制反应的能力在青春期继续发展。 然而,这种执行功能与学术和社会领域的成功高度相关。 因此,我们假设在发育轨迹的早期识别抑制功能不良的标志物将为成功干预提供最佳时间窗口。 了解导致这种抑制功能失败的机制是制定最佳干预措施的关键因素。
产前暴露诊所为产前暴露于酒精和/或其他滥用物质的儿童提供多学科评估,以确定胎儿酒精谱系障碍 (FASD) 谱或其他与产前暴露相关的疾病。 这些评估包括简短的身体检查、与照顾者的面谈,以及对孩子的认知技能和行为/适应性功能的筛查。 我们的评估团队包括一名儿科医生、神经心理学家、职业治疗师、社会工作者和一名心理学家。
我们的后续服务包括针对学龄儿童和青少年的全面神经心理测试和教育咨询。 神经心理学评估将提供对儿童个人学习和行为特征的描述,以及对满足儿童独特学习需求的行为干预和学术教学策略的建议。 我们能够参加 IEP 会议并直接咨询学校工作人员。
首席研究员:Sharon L. Ruyak,护理学院副教授
产前酒精暴露 (PAE) 与称为胎儿酒精谱系障碍 (FASD) 的一系列残疾有关。 FASD 在学龄儿童中的患病率估计在 1.1% 到 5% 之间,使其成为美国最主要的可预防发育障碍形式之一 美国近 40% 的女性报告曾接触过多种童年不良经历 (ACE),其中那些自我报告 ≥ 4 ACE 的人,产前饮酒的风险几乎高出 5 倍。 但是,关于 PAE 和 ACE 对 FASD 发展风险的协同影响的研究有限,这突出表明我们对影响 FASD 易感性的因素的理解存在重大差距。 表观遗传机制,例如调节基因表达的 microRNA (miRNA),作为介导 PAE 和母体 ACE 的长期影响传递给发育中胎儿的机制而受到强烈青睐。 此外,已显示 miRNA 会影响胎盘结构和功能。 胎盘是母亲和胎儿之间的重要界面,促进氧气、营养、激素和废物的交换。 研究表明母体和胎儿细胞在胎盘中双向流动,因此母体循环 miRNA 可能通过这种独特的界面影响后代的结果。 我们的 长期目标 旨在了解影响 FASD 易感性的潜在机制,以便为受 PAE 影响的妇女和婴儿制定有针对性的预防和治疗策略。 该试点提案的目标 是检查与胎盘健康和功能相关的母体循环 miRNA,这些 miRNA 在怀孕期间饮酒的个体中表达水平不同,有和没有显着的 ACE 病史。 我们将通过以下方式实现这一目标:1)使用 miRNA 测序表征 PAE 和 ACE 在母体循环中的差异 miRNA 表达谱,以及 2)通过目标基因的富集分析识别与 PAE 和 ACE 相互作用相关的新信号通路,以确定可能的信号通路涉及胎盘发育、健康和功能的常见分子通路。 拟议工作的完成将为向 NIH 提交的 R01 报告提供初步数据,该报告将检查胎盘功能的作用,以及母体循环因素对胎盘功能的影响,在新生儿神经行为结果的可变性中,用于识别早期接触点高危母亲和婴儿,以及早期干预以减轻 PAE 影响的可能目标。
首席研究员:Nan Zeng,儿科学系预防与人口科学研究助理教授
被诊断患有 FASD 的儿童可能表现出广泛的缺陷,包括可能影响他们在社会中发挥作用的能力的身体、认知、行为和社会心理问题。 因此,旨在促进该人群健康的干预计划是有必要的。 一种可能有望改善 FASD 患者生活多个方面的干预策略是身体活动 (PA)。 除了积极生活方式的一般健康益处(例如,心血管益处)外,PA 还可以改善认知功能的各个方面,特别是执行功能,并且似乎在整个生命周期中都有效。 今天的孩子生活在科技时代,活跃的视频游戏(即运动游戏)是促进和鼓励他们在空闲时间消耗更多能量的理想解决方案。 尽管市售的 Exergaming 对儿童有潜在的健康益处,但这种 PA 模式作为 FASD 儿童的干预策略尚未得到充分研究。 该试点随机对照试验 (RCT) 旨在开发、 实施和评估一项为期 8 周、以家庭为基础、以家庭为中心的随机对照试验,该随机对照试验采用运动游戏来促进 FASD 儿童家庭的运动行为以及抑制控制和注意力. 我们计划使用 LeapTV™ --- 一种专为 16 至 1 岁儿童设计的商用教育锻炼游戏系统,强调通过运动来学习。 我们的目标是招募 2 名亲子二人组来评估 XNUMX) 从父母的角度来看采用和维持 Exergaming 干预的可行性、可接受性、适当性和潜力,以及 XNUMX) 这种干预对儿童身体和生物的初步疗效社会心理健康福利。 这个 PA 干预计划是创新的,因为它采用独特的方法将健康家庭环境的概念融入到运动游戏中,以评估其对合规性、可持续性和可转移性的影响。 该试点研究的成功完成将为该探索性设计过程提供实证基础。 这项试点研究的结果将为 FASD 儿童适当使用运动游戏提供信息,并为未来大规模、多层次、多组成部分的基于家庭的健康媒体干预试验奠定基础,然后可能会对其进行调整或转化为学校或社区环境,并可能产生重大的公共卫生影响。
首席研究员:Valentina Licheri,神经科学系兼职助理教授
临床研究报告说,高达 80% 的被诊断患有胎儿酒精谱系障碍 (FASD) 的儿童表现出明显的睡眠障碍,包括睡眠持续时间短、睡眠焦虑、睡前抵抗、睡眠碎片化增加和异态睡眠,这可能会影响认知功能和破坏性行为的发展. 尽管多项临床前和临床研究表明产前酒精暴露 (PAE) 对睡眠-觉醒行为有影响,但其分子机制尚不清楚。 令人惊讶的是,相对较少的 FASD 动物模型研究描述了发育性乙醇暴露对睡眠生理学的影响,并且这些研究集中在高剂量,产生的血液浓度在 167-500 mg/dl 之间。 然而,在美国和世界各地的许多人群中普遍发生的中度 PAE 的影响尚未得到表征。 此外,基于机器学习的方法在研究睡眠生理学方面取得了相当大的进展,这些方法在啮齿动物模型中发现了 REM 和 NREM 睡眠的三个新子阶段,这些子阶段与人类睡眠阶段非常相似。 我们最近的研究表明,低中度妊娠期酒精暴露能够以性别特异性方式影响认知行为和皮质功能。 中度 PAE 改变了青春期雄性后代的神经胶质谷氨酸转运蛋白,这些转运蛋白参与睡眠和清醒状态下细胞外谷氨酸的控制。 妊娠期酒精暴露会导致 mGluR5R 蛋白显着减少,mGluR40R 蛋白是一种参与睡眠调节的谷氨酸受体。 在 PAE 模型中观察到中间神经病,考虑到皮质中间神经元在睡眠状态中的关键作用,表明可能与睡眠障碍相关。 我假设啮齿动物在相当于人类怀孕的第一和第二个三个月期间适度饮酒会扰乱青春期后代的睡眠生理。 为了检验这一假设,我将研究青春期 PAE 雄性和雌性小鼠(产后 60-1 天)的睡眠-觉醒周期,进行脑电图 (EGG) 和肌电图 (EMG) 记录,并使用基于 AI 的方法描述睡眠子阶段方法。 这个为期 XNUMX 年的试点项目将首次表征中度 PAE 模型对睡眠结构的影响,并提供新的实验框架来表征 FASD 中观察到的睡眠障碍所涉及的分子途径。